Zidentyfikowano nowy cel w leczeniu gruźlicy
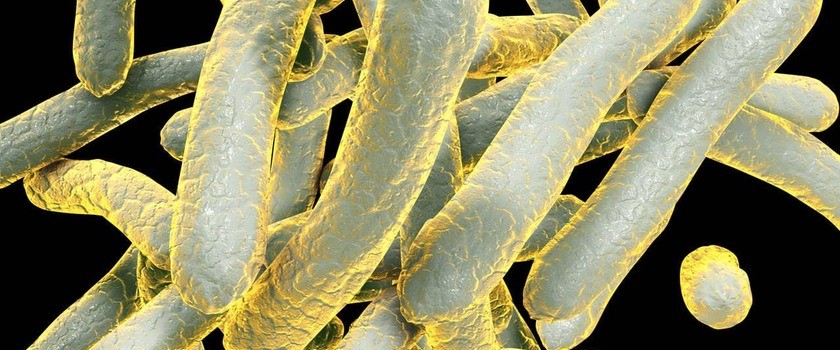
Prątki gruźlicy (łac. Mycobacterium tuberculosis) są poważnym zagrożeniem z perspektywy zdrowia publicznego. W przypadku infekcji leczenie antybiotykami jest możliwe, ale zazwyczaj trudne i długotrwałe. Lekooporne szczepy stały się problemem w wielu regionach świata. Z tego powodu poszukuje się nowych terapii, które będą eliminować patogen poprzez nowe mechanizmy.
Rośnie antybiotykooporność szczepów bakterii wywołujących gruźlicę
Szybki wzrost lekooporności u bakterii jest napędzany przez powszechne stosowanie, nadużywanie i niewłaściwe stosowanie antybiotyków. Stanowi to jeden z najtrudniejszych problemów zdrowotnych na całym świecie. Szacuje się, że zakażenia Mycobacterium tuberculosis doprowadzają do śmierci około 1,5 miliona ludzi rocznie.
Mycobacterium tuberculosis charakteryzują się ograniczoną różnorodnością genetyczną i niskim wskaźnikiem mutacji, co w zasadzie powinno ograniczyć ich zdolność do szybkiego rozwoju oporności na środki przeciwdrobnoustrojowe. Zagrożenia związane z opornością na leki dotyczą przede wszystkim bakterii zdolnych do horyzontalnego transferu genów (czyli do wymieniania się fragmentami genów z innymi bakteriami), do których prątki gruźlicy nie należą. Mimo tego pewne cechy biologiczne pozwalają im stać się lekooporne. W tym przypadku oporność na antybiotykoterapię może wynikać z wielu mechanizmów, takich jak m.in. istnienie hydrofobowej otoczki komórkowej i obecności enzymów rozkładających leki.
Hamowanie enzymu bakteryjnego nową opcją leczenia gruźlicy
Enzym EtfDMtb
Naukowcy z Weill Cornell Medicine zbadali rolę pewnego enzymu bakteryjnego i odkryli, że ma kluczowe znaczenie dla rozkładu dostępnych kwasów tłuszczowych, z których bakterie Mycobacterium tuberculosis czerpią energię, aby przetrwać. Jego usunięcie sprawiło, że patogen nie był zdolny do podtrzymania infekcji. Artykuł na ten temat ukazał się niedawno w „Nature Communications”.
Zdaniem dr Sabine Ehrt, profesor mikrobiologii i immunologii w Weill Cornell Medicine, enzym EtfDMtb jest atrakcyjnym celem leku na gruźlicę. W świetle najnowszych badań okazuje się, że jego wyciszenie przyczynia się do głodzenia bakterii. Ma na nie także toksyczny wpływ.
Mutant M. tuberculosis pozbawiony EtfDMtb nie ma ludzkiego odpowiednika. Kwasy tłuszczowe lub pokrewny im cholesterol nie są w stanie napędzać jego wzrostu. Co więcej, efekt gromadzenia się długołańcuchowych kwasów tłuszczowych działa na niego toksycznie i doprowadza do bezpośredniego uszkodzenia, w związku z czym nie jest w stanie wywołać długotrwałej infekcji.
Enzym NagA
Zakłócenie podstawowych szlaków zaangażowanych w powstawanie ściany komórkowej wydaje się atrakcyjnym podejściem dla nowych leków na gruźlicę. Za pomocą urządzeń rentgenowskich naukowcy sprawdzili, w jaki sposób M. tuberculosis generuje ważne prekursory, które biorą udział w biosyntezie i metabolizmie tej struktury komórkowej. Wyniki pracy ukazały się w czasopiśmie naukowym „Journal of Biological Chemistry” w 2018 roku.
Zespół z University of Warwick, kierowany przez dr Elizabeth Fullam, zidentyfikował motyw strukturalny enzymu N-acetyloglukozamino-6-fosforanowej deacetylazy (NagA). Ekspertka sądzi, że odkrycie „słabego punktu” w tym białku, umożliwi zaprojektowanie odpowiednich cząsteczek, które pozwolą na zablokowanie jego funkcji i wyeliminowanie chorobotwórczych drobnoustrojów.


 Strefa okazji
Strefa okazji
 Nowości
Nowości
 Krótkie daty
Krótkie daty